Nyheder
Høring: Ny forordning om kliniske forsøg
Torsdag den 5. februar deltog CCF i høringen vedr. ny forordning om kliniske forsøg.
---
Ministerrådet og Europa-Parlamentet vedtog i foråret 2014 en ny forordning om kliniske forsøg med lægemidler, som skal erstatte det gældende direktiv om god klinisk praksis ved gennemførelse af kliniske lægemiddelforsøg (GCPdirektivet).
Den nye forordning om kliniske forsøg med lægemidler fastholder centrale principper fra det nuværende GCP-direktiv fra 2001. Som et generelt princip må et klinisk forsøg kun gennemføres, hvis forsøgspersonens rettigheder, sikkerhed og velfærd beskyttes, og hvis data fra forsøget bliver pålidelige og robuste. Desuden videreføres en række kvalitetsstandarder for de forskellige forsøgsfaser og for håndteringen af data. Forordningen skal også sikre mere ens regler både for godkendelse og for den samlede gennemførelse og overvågning af kliniske forsøg i hele EU.
Ministeriet er sammen med Sundhedsstyrelsen og Den Nationale Videnskabsetiske Komité ved at kortlægge nye arbejdsgange og nødvendige lovændringer som følge af forordningen.
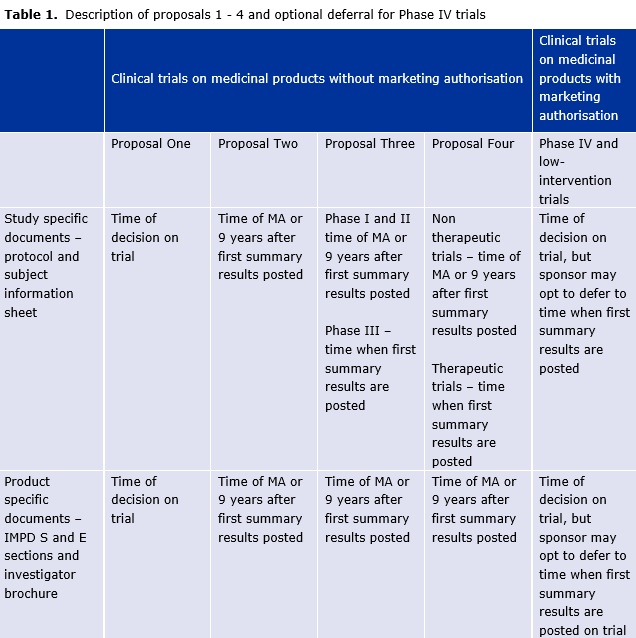
Hovedindholdet af en ny høring fra Det Europæiske Lægemiddelagentur (EMA) om åbenhed om kliniske forsøgsdata kan findes hér: http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2015/01/news_detail_002253.jsp&mid=WC0b01ac058004d5c1
Af CCF den 06/02/15
CCF uddeler 500.000 kr. til forskning i 2015
Forskning i mave- tarmsygdomme ... Læs mere
Forskning i mave- tarmsygdomme ... Læs mere
Af CCF den 25/03/15
Ung dansk læge modtager talentpris
Fokus på forskning i mave- tarmsygdomme ... Læs mere
Fokus på forskning i mave- tarmsygdomme ... Læs mere
Af CCF den 24/03/15





